
先発品とは?
新しく開発・発売された医薬品を先発品(新薬)といいます。
新薬を開発した製薬会社には、特許の出願により20〜25年、
特許の権利が与えられ、独占的に製造販売することができます。
また別に、おくすりの発売から4〜10年は有効性と安全性を
確認することが義務付けられています。
後発品(ジェネリック医薬品)とは?
新薬の特許期間が満了した後、厚生労働省の承認を得て有効性
と安全性が確かめられた後に販売される医薬品。
その定義を後発品とは、既承認医薬品と有効成分が同一であって、
投与経路、用法、用量、効能および効果が同一である医薬品。
欧米では後発品の処方が一般名(generic name)で行われることから
後発品は「ジェネリック医薬品」とも呼ばれています。
●ジェネリック医薬品の工夫と薬剤費軽減
お子さまやお年寄りの方が飲みやすいように、カプセル剤を小さくしたり、味や香りを工夫しています。
また、湿気や光に強くすることで、一包化しても製剤の安定性が保たれるように、改良しています。
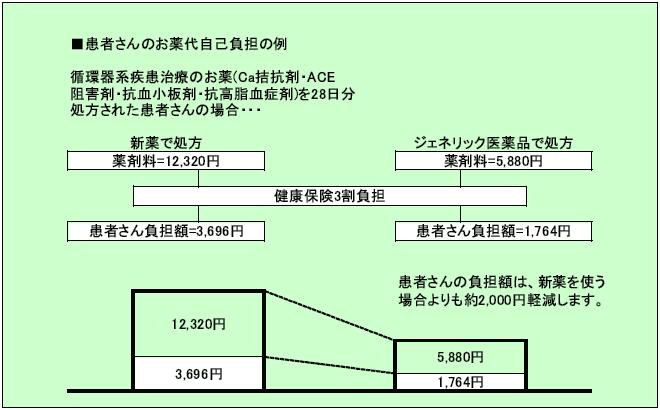
そして、ジェネリック医薬品の最大のメリットは、新薬と同じ効果で価格が安いので、患者様負担が少なくすむとゆうこと、すなわち医療費削減に貢献出来るのです。
●生物学的同等性試験
健常成人志願者を対象として、先発品とジェネリック品をそれぞれ投与し、投与後の血中薬物時間推移(バイオアベイラビリティ)が重なっていることを示すことによって、臨床上の同等性を実証する試験のこと。
●品質再評価とは
内服固形製剤について、同じ成分の医薬品が同じように溶解されることにより、同じ効果が得られるとゆう考え方に基づき、行われる溶出試験により品質の確認をするものです。
適切な溶出試験を設けることにより、溶出に係る品質が適当なものであることを確認するとともに、品質を一定の基準を確保することを目的としております。
また、この品質再評価の結果は日本版オレンジブックと呼ばれる「医療用医薬品品質情報集」に掲載されます。
この品質再評価は、ジェネリック医薬品の使用促進と品質確保を目的として、内服固形製剤を対象に平成9年から実施されています。
●溶出試験
製剤の主成分の溶け出る時間と割合を測定する試験。
品質再評価においては、水及びpHの異なる3種類(酸性・中性・アルカリ性)の溶解液に固形製剤を溶かし、先発品とジェネリック医薬品の同等性を確認する試験のこと。
●オレンジブック
原版はアメリカの厚生労働省にあたるFDA(食品医薬品局)で発行されているもので、品質再評価の実施結果をまとめたものが日本版オレンジッブックです。
日本版オレンジブックでは公的溶出試験方法とその結果を公表することにより、品質保証の手段の一つとするものであり、また公的溶出試験の進捗状況を明らかにすることを目的としています。
日本版オレンジブックは薬事日報社から発刊されています。
|
Copyright © 2005 Sanwa Pharmaceutical Co.,ltd. all rights reserved.
|
|